PORTEC-4a:子宫内膜癌治疗的分子精准诊疗转折点?
新闻来源: 发布时间:[2026-02-06]
子宫内膜癌是女性生殖系统最常见的恶性肿瘤之一,近年来其发病率持续上升。传统的治疗策略主要基于临床病理特征进行风险分层,但这种方法存在一定的局限性。高中危子宫内膜癌的标准辅助治疗为阴道近距离放射治疗(阴道内照射),虽可提高局部控制率,但存在过度治疗和治疗不足的问题。随着TCGA(癌症基因组图谱)对子宫内膜癌的分子分型(POLE突变型、MSI型、低拷贝数型、高拷贝数型)的提出,结合其他风险因素(如L1-CAM过表达、明显淋巴血管间隙侵犯等),可更精准评估复发风险,PORTEC-4a试验作为一项旨在探索基于分子风险特征的个体化辅助治疗在高中危子宫内膜癌患者中的应用价值的国际多中心、前瞻性、随机对照的III期临床试验也应运而生[1],实现更为精准的个体化治疗,减少不必要治疗,优化医疗资源使用,同时维持疗效,其成果有望改写子宫内膜癌的临床治疗指南。
分子分型:精准治疗的新基石
PORTEC-3 巩固了放化疗在Ⅲ期与p53abn中的地位,并提示POLEmut/MMRd不必为化疗买单,NSMP需结合ER精细化决策。而PORTEC-4a试验基于新发现并提出了新的治疗策略,MMRd和NSMP肿瘤的管理范围可从单纯观察到阴道近距离放疗或外照射放疗不等,把分子整合风险真正嵌入术后放疗决策,近半数患者在分子分型细化下,实现安全放疗的豁免,为资源优化与毒性减负提供了随机证据,实现了真正意义上的个体化治疗。
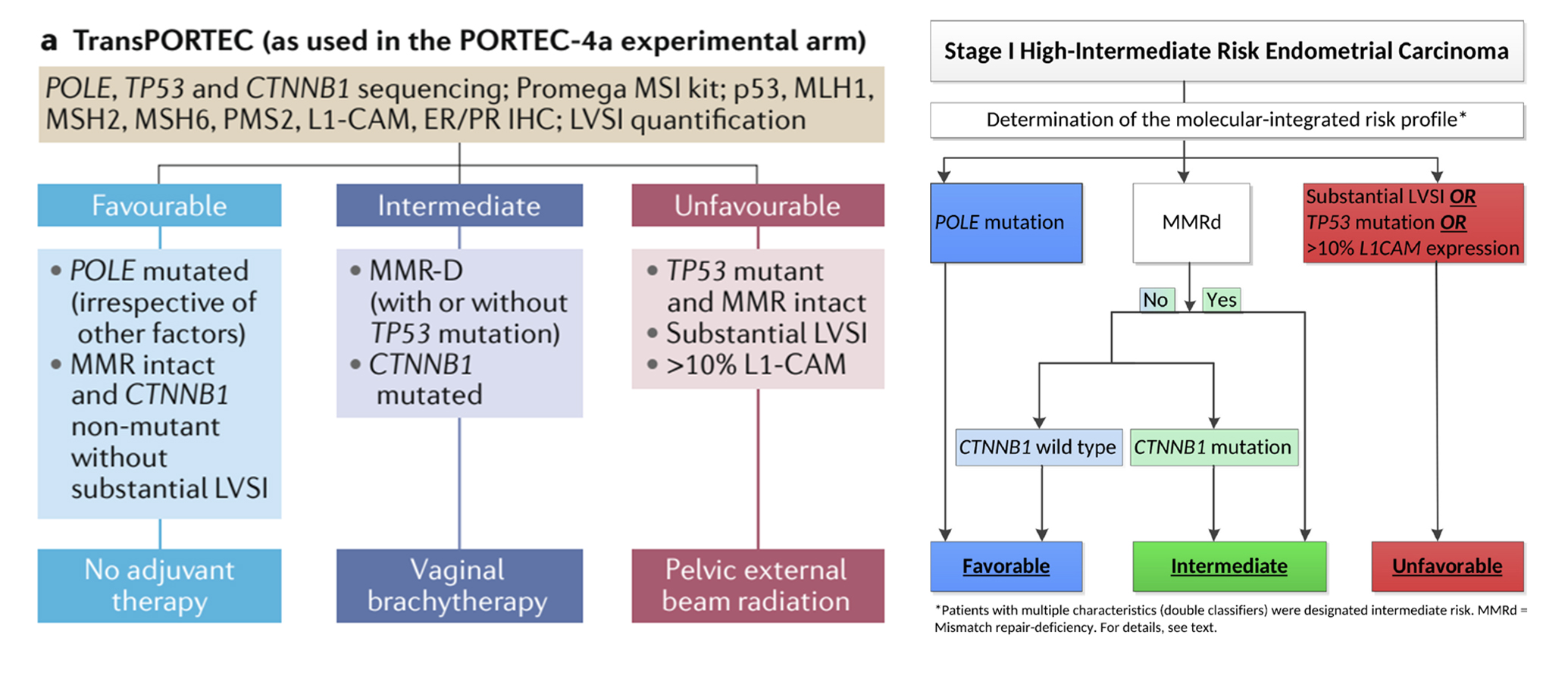
PORTEC-4a将CTNNB1纳入分型指标,进一步判断无特异分子谱组(NSMP)的预后
不同分子亚型的子宫内膜癌具有截然不同的预后和治疗反应:
1. POLE突变型肿瘤:由于其极佳的预后,仅需观察随访,无需辅助治疗;
2. p53异常型(p53abn):与不良预后相关,似乎能从外照射放疗(EBRT)中获益;
3. 错配修复缺陷型(MMRd)和无特殊分子特征型(NSMP):这两类肿瘤的预后具有异质性,需要结合L1CAM过表达、显著的淋巴血管间隙浸润(LVSI)和CTNNB1外显子3突变等因素进一步细化风险分层。
PORTEC-4a试验的核心创新在于将分子分型整合到临床决策中,它突破了传统以病理特征为主的风险分层模式,通过对患者肿瘤组织的分子生物学特征进行深入分析,将TCGA分子分型与临床病理因素(如肿瘤分级、肌层浸润深度等)相结合,构建了更为精细化的风险评估体系。这种基于分子特征的个体化治疗策略,不仅提高了治疗的精准度,也为临床医生制定个性化治疗方案提供了有力的循证医学依据,推动子宫内膜癌辅助治疗从“一刀切”的模式向更加精准化、个体化的方向迈进。
临床结果与争议:阴道复发VS整体复发
PORTEC-4a试验共纳入564例患者,结果显示仅有21例(4%)发生阴道复发,65例(12%)发生任何部位复发,62例(11%)发生总体生存事件[2]。这些数据表明,单纯关注阴道复发可能低估了疾病复发的整体负担,尤其是在缺乏系统分期的情况下。
一个关键问题是中危子宫内膜癌患者常规阴道近距离放疗的作用。虽然阴道近距离放疗能有效降低阴道复发,但中危组患者的大多数复发发生在盆腔或远处(分别为213例中的12例(6%)和23例(11%)),这些部位不太可能从局部治疗中获益[2]。此外,阴道复发通常可以通过挽救治疗控制,这引发了人们对辅助阴道近距离放疗是否能提供有意义的总体生存和无复发生存获益的质疑。
试验设计的局限性
尽管PORTEC-4a试验在方法学上具有严谨性,但几项设计特征值得关注:
· 分期不完整风险:研究中仅25%的患者接受了淋巴结评估,且术前影像非常规进行,可能导致部分患者分期被低估,影响治疗决策的准确性。
· 研究终点的局限性:研究主要关注阴道复发,但大多数复发发生在盆腔或远处,这些部位的复发更影响总生存期。因此,仅凭阴道复发率低是否足以支持该策略全面推广,仍有争议。
· 分子标志物的标准化与可及性:目前分子分型尚需额外检测,且部分标志物(如L1CAM、CTNNB1)的预后价值仍存争议,全球范围内推广面临成本、时间与公平性挑战。
虽然这些标准与当时的护理标准一致,但它们引入了不可忽视的低估正确疾病分期的风险,特别是在有隐匿性淋巴结疾病的患者中,这可能是观察到的盆腔复发的原因之一。事实上,先前的一项研究报道,在看似FIGO 2009 IA G3期、IB G1-G2期和IB G3期子宫内膜样腺癌中,淋巴结受累(不包括孤立肿瘤细胞)的发生率分别为5%、18%和19%,这些肿瘤类别分别占PORTEC-4a试验人群的13%、80%和2%[3]。
与当前指南的差异与未来方向
值得注意的是,PORTEC-4a策略与当前的欧洲妇科肿瘤学会(ESGO)、欧洲放射肿瘤学会(ESTRO)和欧洲病理学会(ESP)指南存在差异。现行指南推荐在p53abn亚组或NSMP亚组中存在侵袭性组织学或雌激素受体阴性的患者接受辅助化疗联合或不联合EBRT(体外放射治疗)[4]。
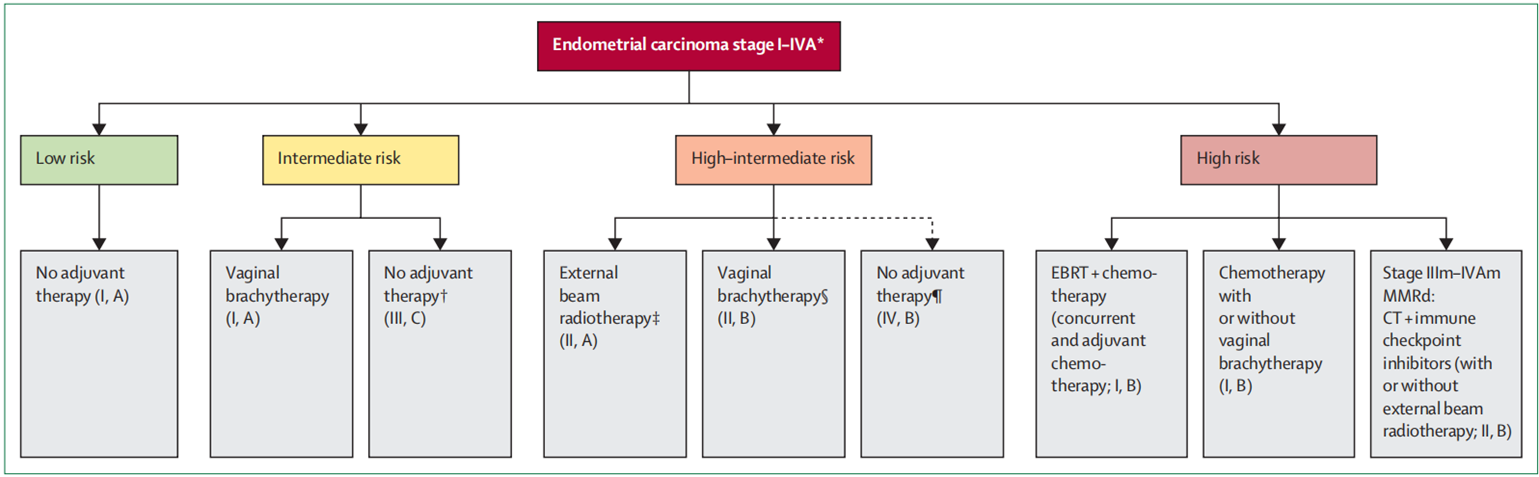
子宫内膜癌IA-IVA期辅助治疗方案[4]
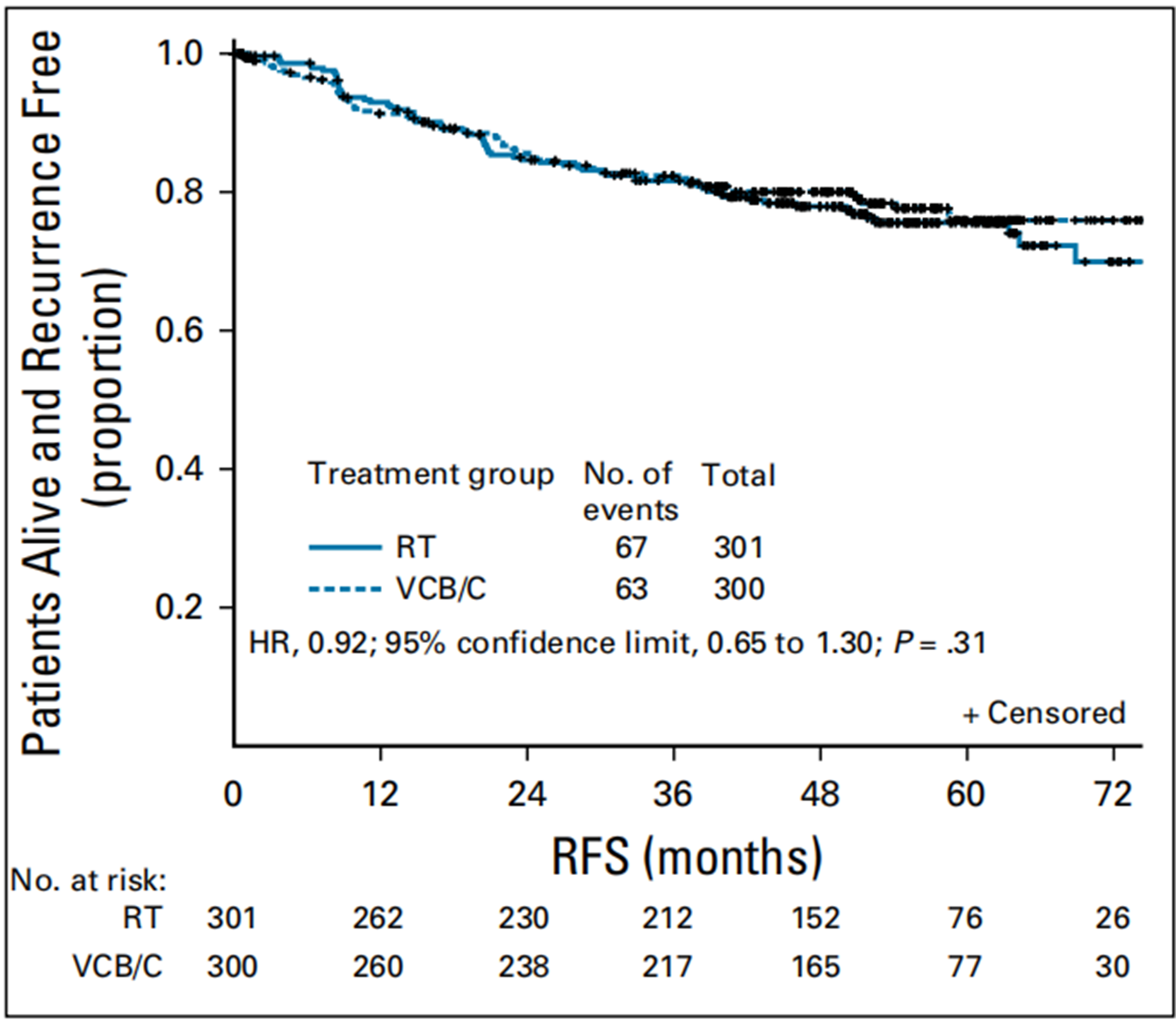
意向性治疗分析显示的无复发生存期按随机治疗分组[5]
GOG-249试验显示,在高危和中高危队列中,阴道近距离放疗加化疗与单纯盆腔放疗的复发率相当[5]。这引发了一个关键问题:既然化疗目前仍是指南所规定的标准疗法,那么化疗是否已足够,而EBRT是否可推迟至复发时再使用呢?综合这些观点,支持对经过适当分层的患者选择性地省略放疗,将放疗策略性地留作挽救治疗手段,因为放疗在挽救治疗中的疗效已得到充分验证。
实施挑战:从实验室到临床
除了临床结果外,PORTEC-4a模型的实施还带来了逻辑和经济挑战。该分子算法是在认识到雌激素受体状态的预后意义之前设计的,导致识别出雌激素受体阴性或高级别NSMP亚组具有较差的预后[6,7]。而PORTEC-4a分层模型包括L1CAM过表达和CTNNB1突变,这些生物标志物的预后影响仍有争议,且未在各研究中得到一致验证[6-8]。
将这种扩展的检测 panel 整合到临床工作流程中需要超出当前标准的额外分子检测,这引发了关于全球范围内可行性、周转时间、公平获取和资源分配的担忧。迫切需要健康经济评估,以确定PORTEC-4a分子指导策略是否具有成本效益,并能在不同的医疗保健系统中实施。
转折点还是里程碑?
van den Heerik及其同事的研究无疑是该领域的重大贡献,为风险适应性治疗提供了新框架,并为子宫内膜癌的精准肿瘤学设定了新基准。然而,在将其整合到常规实践之前,必须仔细解决与分期完整性、生物标志物验证和实际实施相关的关键问题。几项正在进行/已结束的研究,包括RAINBO[9]和PETREC[10]试验等,旨在验证和扩展这些发现,并将在验证这种方法以及使不断发展的分子证据与现实世界临床决策保持一致方面发挥关键作用。
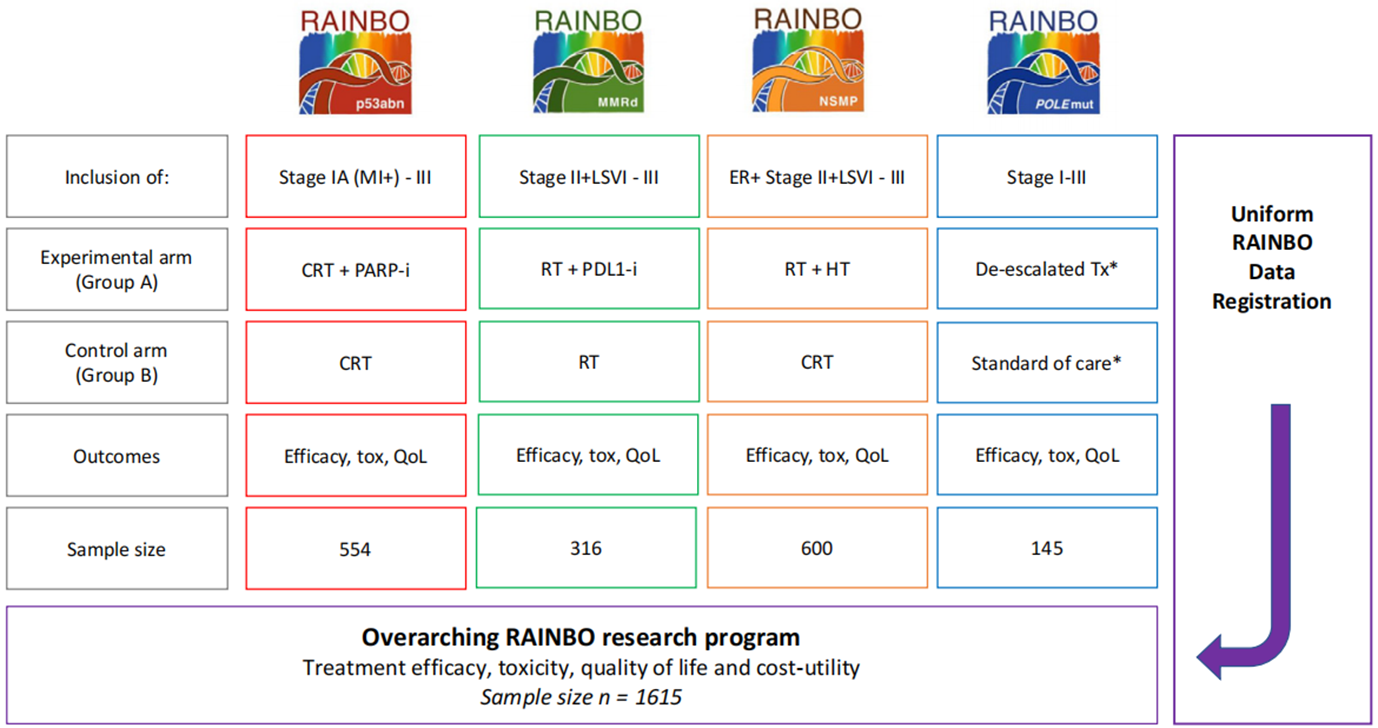
RAINBO临床试验的总研究项目的样本量[9]
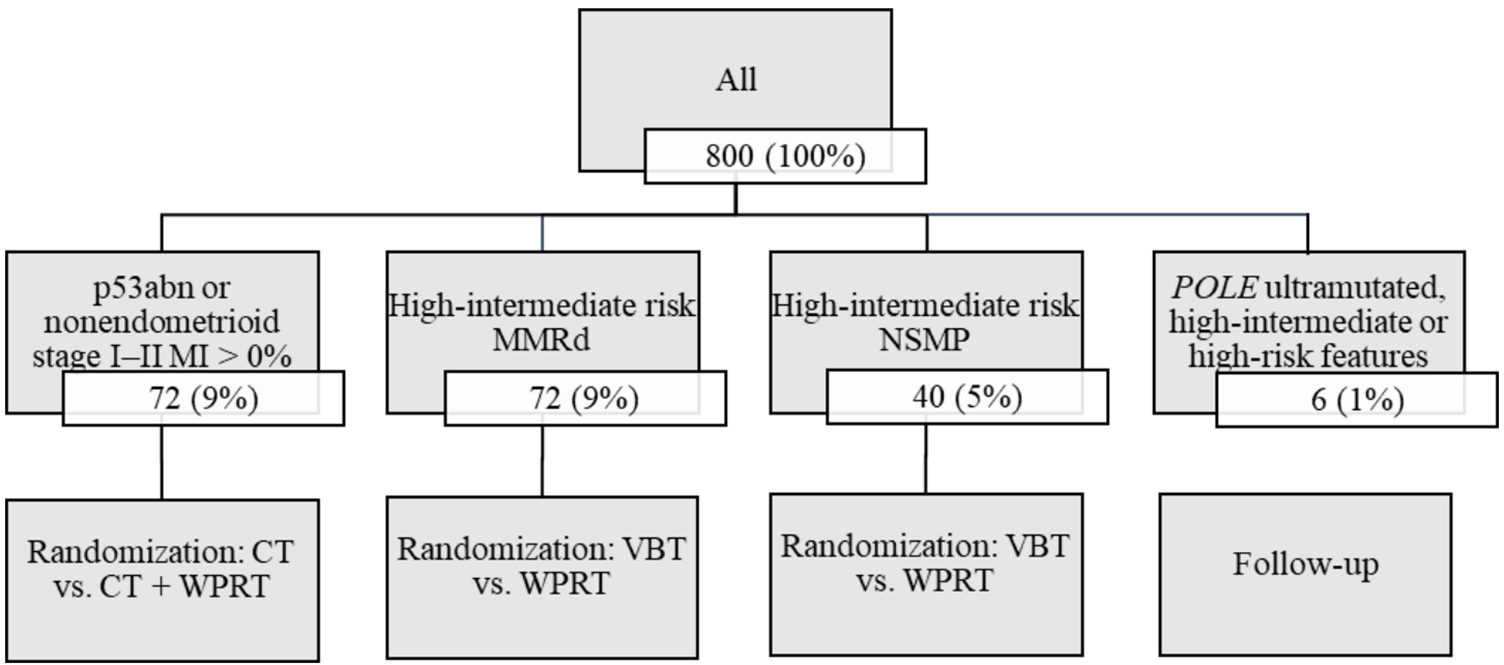
PETREC试验中的治疗组分配情况[10]
未来的治疗路径或将遵循先通过分子分型进行风险分层和初步治疗方向选择(PORTEC-4a,实现了临床实践的初步转化,成功“做减法”减免过度治疗),再根据分期和分型进入不同的强化治疗平台(RAINBO,精准强化“做加法”探索靶向/免疫治疗),并在整个放疗过程中采用最优技术(PETREC)以最大化疗效并最小化毒性。
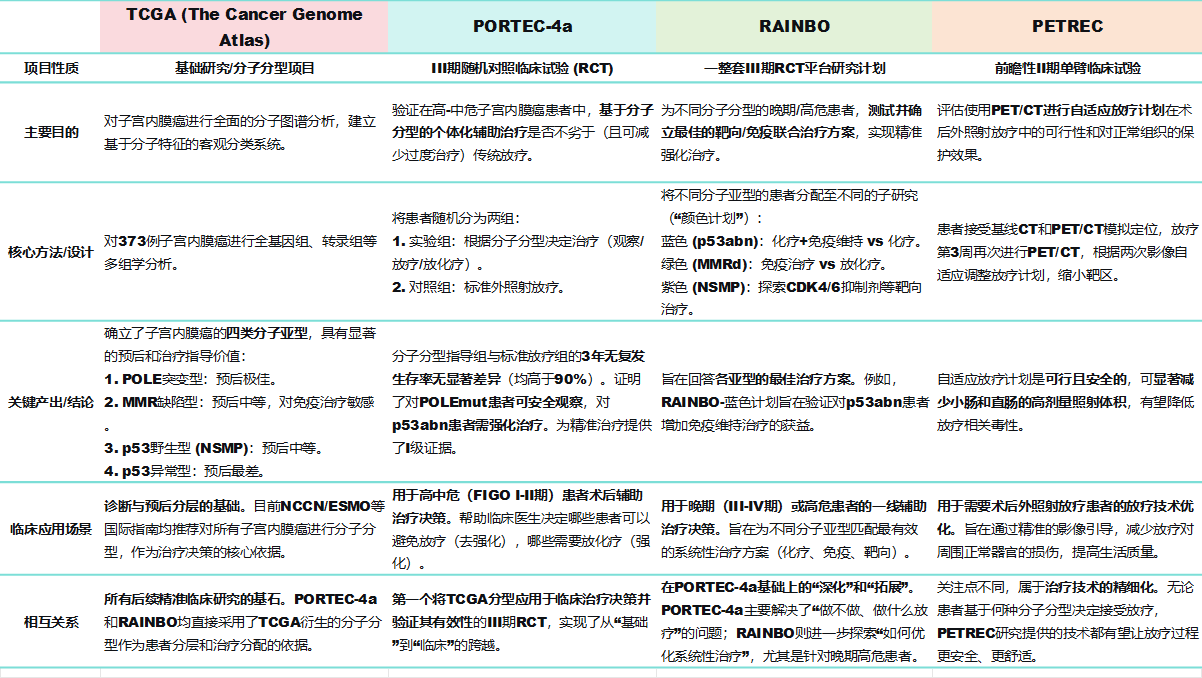
纵观PORTEC-4a是否标志着子宫内膜癌管理的真正转折点,最终将取决于其可重复性、可及性以及对长期结果的影响。无论如何,这项研究无疑推动了子宫内膜癌治疗向更加个体化、精准化的方向迈进,为患者带来了新的希望。
参考文献
[1] Int J Gynecol Cancer 2020; 30: 2002–07.
[2] Lancet Oncol 2026; 27: 23–35.
[3] Int J Gynecol Cancer 2024; 34: 689–96.
[4] Lancet Oncol 2025; 26: e423–e435.
[5] J Clin Oncol 2019; 37: 1810–18.
[6] Br J Cancer 2023; 128: 1360–68.
[7] Mod Pathol 2023; 36: 100085.
[8] Clin Cancer Res 2016; 22: 4215–24.
[9] Int J Gynecol Cancer 2023; 33: 109–17.
[10] Int J Gynecol Cancer 2023; 33: 1807–11.
声明:本文仅用于分享,如涉及版权等问题,请尽快联系我们,我们第一时间更正,谢谢!