子宫内膜癌分子分型扩展应用(二)
新闻来源: 发布时间:[2026-01-20]
上篇文章(子宫内膜癌分子分型的拓展应用(一))已经简单介绍了子宫内膜癌分子分型在卵巢子宫内膜癌样癌中的目前应用情况。在妇科恶性肿瘤中,子宫内膜癌和卵巢癌并存是一种相对少见但并不罕见的现象,约10%的卵巢癌患者及5%的子宫内膜癌患者可能存在这种情况,占女性生殖系统恶性肿瘤的0.63%,病理类型以子宫内膜样腺癌多见(约占46%~85%)[1]。临床数据显示,约5%的子宫内膜癌患者伴发卵巢癌,10%的卵巢癌患者伴发子宫内膜癌,此类患者的预后异质性极大,5年生存率波动于30%~90%。目前区分原发性双癌和转移癌主要依据Scully制定的组织病理学标准,但是目前仍存在存在15%-30%误诊率。

Scully诊断和风险分组标准[1]
2013年癌症基因组图谱(TCGA)首次建立子宫内膜癌分子分型体系,2015年后ProMisE等实用方案的推广,为子宫 卵巢同步性内膜样癌(synchronous endometrial and ovarian endometrioid carcinoma,SEO EC)的精准诊疗提供了全新视角。分子分型通过解析POLE基因突变、错配修复缺陷(MMRd)、p53状态及无特异分子特征(NSMP)四大亚型,不仅能明确双病灶的克隆起源(独立原发vs克隆相关转移),更能指导治疗分层与预后预测。
近5~10年,基因组学技术通过绘制和比对SEO EC宫体和卵巢2个部位癌灶的基因组全景图,已经证实,绝大多数SEO EC是原发于宫体部位的内膜样癌转移至卵巢的结果。一篇综述针对下图12篇SEO EC基因组学研究的文献进行总结分析发现,在160例SEO EC中,绝大多数(96.9%)SEO EC的宫体和卵巢癌灶均具有克隆性,仅5例(3.1%)被证实为各自独立原发,并且其中3例均为Lynch综合征。

子宫 卵巢同步性癌克隆性来源总结分析[1]
一项研究纳入28例病例,针对宫体灶和卵巢灶都进行了NGS检测,最终发现23例(82.1%)患者的宫体和卵巢癌灶组织学分级相同,96.4%(27例)的SEO EC患者宫体和卵巢癌灶具有一致的分子分型,仅1例有所不同。所有患者均具有共享体细胞基因变异位点,平均每例患者共享体细胞基因变异7.4(1~41)个位点。最常见的共享体细胞变异基因依次为PTEN(64.3%,18/28)、PIK3CA(46.4%,13/28)、ARID1A(28.6%,8/28)、CTNNB1(25.0%,7/28)和KRAS(21.4%,6/28)[2]。另有一项研究,纳入17例患者(转移11例/双原发6例),发现94%(16/17)存在克隆相关性[3]。
传统Scully病理标准(1998)通过肿瘤大小、分化程度、脉管浸润等形态学特征区分双原发癌(低危)与转移癌(高危),但存在显著局限性。子宫内膜癌分子分型可通过以下维度实现精准鉴别:
1. 克隆相关性分析:多项研究显示,SEO EC存在克隆相关性(同一分子亚型+共享基因突变),但临床行为仍为低危,提示“克隆起源≠转移”,预后取决于分子亚型而非克隆关系。
2. p53abn亚型的特异性:转移癌中p53abn占比63.6%,而双原发癌仅9.7%,提示p53abn是转移癌的强预测因子(OR=11.07,95%CI1.45-84.50)。
3. MMR状态异质性:多数SEO EC双病灶分子亚型一致,但仍存在极少数的不一致现象,提示必须对双病灶分别进行分子检测,避免单一病灶取样导致的误诊。
文献报道,林奇综合征患者的占比在SEO EC(7%~14%)中高于宫体内膜样癌(2%~6%)和卵巢内膜样癌(约6%)。提示对于SEO EC,在完善分子分型同时,尽量完善检测,以排除胚系致病性基因变异所导致的肿瘤性遗传综合征,并筛选可从免疫治疗中获益的患者。
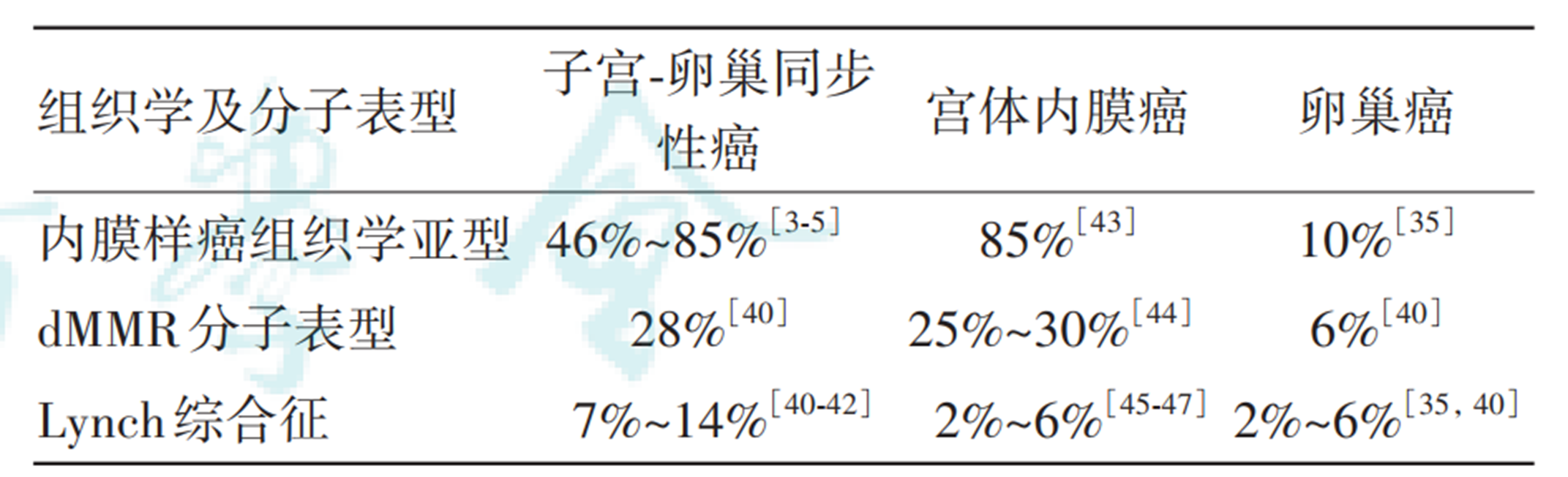
内膜样组织学亚型、dMMR分子表型及Lynch综合征在3种肿瘤患者中的占比情况[1]
卵巢子宫双原发癌的子宫内膜癌分子分型已从科研走向临床,成为破解诊断困境、优化治疗策略、精准预后评估的核心工具。POLEmut亚型的“零复发”特征支持降阶梯治疗,p53abn亚型的高侵袭性要求强化治疗,MMRd亚型为免疫治疗提供靶点,NSMP亚型需结合更多biomarker进一步分层——这种“分子优先”的诊疗模式,使SEO EC的精准医疗成为可能。
未来,随着检测技术的标准化、前瞻性研究的开展及靶向/免疫治疗的突破,分子分型将进一步重塑SEO EC的临床实践,最终实现“个体化治疗”与“疗效最大化、毒性最小化”的目标。
参考文献
[1] 赵肖雅,刘从容. 子宫-卵巢同步性内膜样癌分子遗传学研究进展及风险分组内涵和标准的变更[J]. 中华病理学杂志,2025,54(11):1240-1246.DOI:10.3760/cma.j.cn112151-20250328-00220
[2] 赵肖雅,曹芳,宋子秀,等. 子宫-卵巢同步性内膜样癌临床病理学及分子遗传学分析[J]. 中华医学杂志,2025,105(08):584-591.DOI:10.3760/cma.j.cn112137-20241107-02491
[3] Pelosi E, et al. Synchronous Endometrial and Ovarian Carcinomas: Pathologic and Molecular Analysis Highlights the Monoclonal Origin of the Lesions. Gynecol Oncol. 2025;178:234-242.
声明:本文仅用于分享,如涉及版权等问题,请尽快联系我们,我们第一时间更正,谢谢!